A-level化学知识点梳理系列(十一)
点击量: 发布日期:2019-06-22 作者:四老师
化学平衡与化学反应速率(一)
我们以前接触到的化学反应都是可以完全进行的,也就是说只有当至少一种反应物完全消耗完,反应才会停止。但是接下来我们也接触一类特殊的反应,称为可逆反应。
一、可逆反应与平衡
A reaction in which the products can react together to re-form the original reactants is called a reversible reaction.如果一个反应,在反应物变成生成物的同时,生成物也在变成反应物,那么这个反应就是可逆反应。
The products react together to re-form reactants at the same speed as the reactants are forming products. This type of reversible reaction is called an equilibrium reaction.如果反应物变成生成物的速率和生成物变成反应物的速率相等,就说这个反应达到了平衡。
characteristics of equilibrium平衡有以下五个特点:
1. it is dynamic平衡是动态的
2. the forward and backward reactions occur at the same rate
正反应和逆反应进行的速率相等
3. the concentrations of reactants and products remain constant
反应物和生成物的浓度保持不变
4. equilibrium requires a closed system
平衡体系是一个封闭的体系,即没有与外界的物质交换
changing the position of equilibrium平衡的移动
Le Chatelier’s principle: if one or more factors that affect an equilibrium changed, the position of equilibrium shifts in the direction which reduces (opposes) the change.
勒夏特列原理:当影响平衡的某个因素改变时,平衡会向抵消这个改变因素的方向移动。这么说可能有些抽象,我们会在分析以下几个因素的改变时详细说明。
* the effect of concentration浓度的影响
如果增大反应物的浓度,或者减小生成物的浓度,平衡就会正向移动,这样可以部分地减小反应物的浓度,或者增大生成物的浓度。反之,如果减小反应物的浓度,或者增大生成物的浓度,平衡就会逆向移动。
* the effect of pressure压强的影响
压强只会影响到有气体参与的平衡。比较反应物和生成物的气体摩尔数,如果增大压强,平衡向气体摩尔数小的一方移动;反之,如果减小压强,平衡向气体摩尔数大的一方移动。如果反应物和生成物的气体摩尔数相等,则改变压强平衡不移动。
* the effect of temperature温度的影响
当温度升高时,平衡向吸热反应方向移动;当温度降低时,平衡向放热反应方向移动。
* catalysts don’t change the position of equilibrium催化剂的影响
催化剂相同程度地提高正反方向的反应,因此平衡不移动。
二、平衡常数
平衡常数的表达式
对于反应mA + nB → pC + qD
Kc的数值与浓度无关,与压强无关,只与温度有关,相应的关系是

对于一个气体反应来说,可以用气体的分压来代替浓度,得到Kp的表达式。
化学平衡是一个非常重要的知识点,经常出现在选择题和大题中,会要求利用勒夏特列原理判断平衡移动的方向,还会涉及平衡常数的运算。我们来看两个例子。
s12-qp12
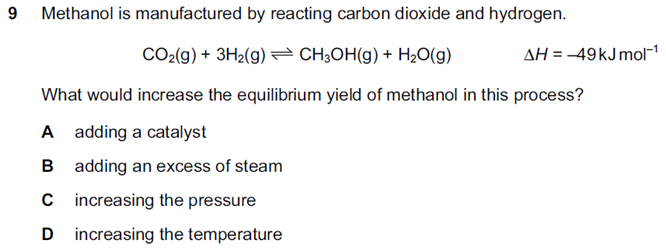
解析:这道题在考察ABCD四个条件,哪个可以使平衡正向移动。A使用催化剂不会改变平衡,B提高水的浓度,会使平衡逆向移动。C增加压强,反应物气体总摩尔数为4,生成物气体总摩尔数为2,所以平衡正向移动。D提高温度,平衡向吸热反应方向移动,即向逆方向移动。因此选C。

解析:本题的难度比较大,但是要沉住气,先按照A的方程来判断是否正确,一开始P有2mol,平衡时R有xmol,那么P还剩(2-x)mol,Q有2x mol,因此总摩尔数为2-x+x+2x=2+2x,错误。依次判断,可知B正确。
我们以前接触到的化学反应都是可以完全进行的,也就是说只有当至少一种反应物完全消耗完,反应才会停止。但是接下来我们也接触一类特殊的反应,称为可逆反应。
一、可逆反应与平衡
A reaction in which the products can react together to re-form the original reactants is called a reversible reaction.如果一个反应,在反应物变成生成物的同时,生成物也在变成反应物,那么这个反应就是可逆反应。
The products react together to re-form reactants at the same speed as the reactants are forming products. This type of reversible reaction is called an equilibrium reaction.如果反应物变成生成物的速率和生成物变成反应物的速率相等,就说这个反应达到了平衡。
characteristics of equilibrium平衡有以下五个特点:
1. it is dynamic平衡是动态的
2. the forward and backward reactions occur at the same rate
正反应和逆反应进行的速率相等
3. the concentrations of reactants and products remain constant
反应物和生成物的浓度保持不变
4. equilibrium requires a closed system
平衡体系是一个封闭的体系,即没有与外界的物质交换
changing the position of equilibrium平衡的移动
Le Chatelier’s principle: if one or more factors that affect an equilibrium changed, the position of equilibrium shifts in the direction which reduces (opposes) the change.
勒夏特列原理:当影响平衡的某个因素改变时,平衡会向抵消这个改变因素的方向移动。这么说可能有些抽象,我们会在分析以下几个因素的改变时详细说明。
* the effect of concentration浓度的影响
如果增大反应物的浓度,或者减小生成物的浓度,平衡就会正向移动,这样可以部分地减小反应物的浓度,或者增大生成物的浓度。反之,如果减小反应物的浓度,或者增大生成物的浓度,平衡就会逆向移动。
* the effect of pressure压强的影响
压强只会影响到有气体参与的平衡。比较反应物和生成物的气体摩尔数,如果增大压强,平衡向气体摩尔数小的一方移动;反之,如果减小压强,平衡向气体摩尔数大的一方移动。如果反应物和生成物的气体摩尔数相等,则改变压强平衡不移动。
* the effect of temperature温度的影响
当温度升高时,平衡向吸热反应方向移动;当温度降低时,平衡向放热反应方向移动。
* catalysts don’t change the position of equilibrium催化剂的影响
催化剂相同程度地提高正反方向的反应,因此平衡不移动。
二、平衡常数
平衡常数的表达式
对于反应mA + nB → pC + qD
Kc的数值与浓度无关,与压强无关,只与温度有关,相应的关系是

对于一个气体反应来说,可以用气体的分压来代替浓度,得到Kp的表达式。
化学平衡是一个非常重要的知识点,经常出现在选择题和大题中,会要求利用勒夏特列原理判断平衡移动的方向,还会涉及平衡常数的运算。我们来看两个例子。
s12-qp12
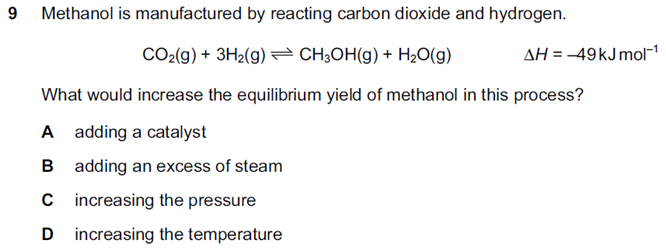
解析:这道题在考察ABCD四个条件,哪个可以使平衡正向移动。A使用催化剂不会改变平衡,B提高水的浓度,会使平衡逆向移动。C增加压强,反应物气体总摩尔数为4,生成物气体总摩尔数为2,所以平衡正向移动。D提高温度,平衡向吸热反应方向移动,即向逆方向移动。因此选C。

解析:本题的难度比较大,但是要沉住气,先按照A的方程来判断是否正确,一开始P有2mol,平衡时R有xmol,那么P还剩(2-x)mol,Q有2x mol,因此总摩尔数为2-x+x+2x=2+2x,错误。依次判断,可知B正确。
9年专注国际课程辅导培训
alevel、IB、AP、SAT2、IGCSE
上海天山总部:长宁区SOHO天山广场
上海浦东校区:浦东新区商城路618号良友大厦
上海七宝校区:闵行区新龙路399弄1号宝龙城
咨询热线:4006-321-553
广州校区:天河区体育西维多利广场
咨询热线:4006-321-556
宁波校区:宁波市鄞州区钱湖北路555号知识星球
咨询热线:4006-321-572




