联系我们
热门标签
生物 IB 数学 历史 sat 英语 中文 心理学 化学 成绩 物理 igcse辅导 IGCSE课程 ib课程 ib辅导 IB培训 IGCSE培训 ALEVEL课程 ALEVEL辅导 ALEVEL培训 ALevel经济 IGCSE英语 IB中文 IB历史 IB化学A-level化学:电极电势与原电池
当你把一块锌片放入含有锌离子的溶液(如ZnSO4溶液)中时,就会产生电势,这个电势是怎么来的呢?浸在溶液里的锌片表面会有一小部分锌原子失去电子成为锌离子进入溶液中,这导致锌片有了过量的电子,溶液中则有了过量的阳离子,溶液中的阳离子呢又会因带正电而被有着过量电子的锌片所吸引,所以在锌片表面和溶液中被吸引的锌离子之间产生了电势。如下图:
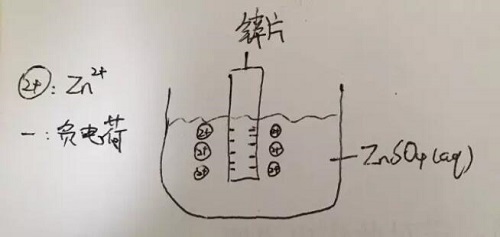
以上,就是一个half-cell(半电池)的电势的产生。
此时,半电池中产生了一个化学平衡:
在这里需要知道的是,每一个半电池,在产生电势的同时,都会存在一个化学平衡,而这个化学平衡规定为还原反应,所以在书写半电池的方程式时,注意电子要写在可逆符号左边。一个半电池也可以用一个化学平衡来表示。
电极电势和氧化还原反应有什么关系呢?
一个半电池的电极电势越正(positive),其中的阳离子更容易得到电子,而得电子的能力,就是氧化性,所以阳离子的氧化性就越强,对应的金属还原性就越弱(越不容易失去电子)。
举个栗子:电极电势= -0.76V
电极电势=+0.34V
/Cu半电池的电极电势更正,所以铜离子更容易得到电子,也就是说铜离子氧化性强,铜金属还原性弱。
/Zn半电池的电极电势更负,所以锌离子较难得到电子,锌离子氧化性弱,锌金属还原性强。
所以说,通过电极电势,我们可以判断出金属失去/得到电子的能力。
怎么测量一个半电池的电极电势呢?
一个half-cell的电势是无法单独来测量的,所以我们(化学家们。。。)为了方便测量不同金属和溶液组成的半电池的电势,规定了一个标准氢电极电势,standard hydrogen potential。如下图
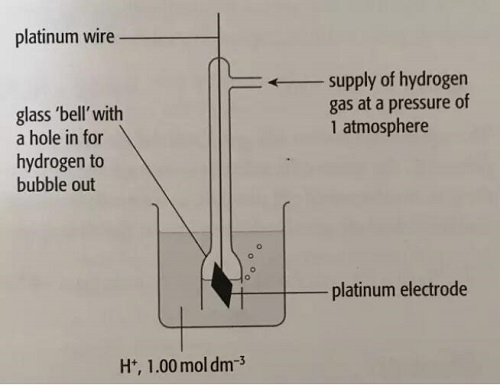
注意:考试曾经常考到这张图
此图要点:
1.纯净的,1大气压下的hydrogen gas通过管子进入溶液;
2.溶液是氢离子浓度为1mol/L的溶液;
3.那个黑色的是铂片,作用是使氢气和氢离子更好地接触来快速达到化学平衡;
以上的要点中包括了“标准”的条件,既1大气压,1mol/L,有铂片。这个标准氢半电池的电势则规定为零。这样,当我们将另一个半电池和标准氢半电池连到一起形成一个原电池时,那个半电池的电势就可以通过电压表测出来了。通过这个方法,也就是在标准状况下,以标准氢半电池为参照物测量出来的电极电势,就叫做标准电极电势。
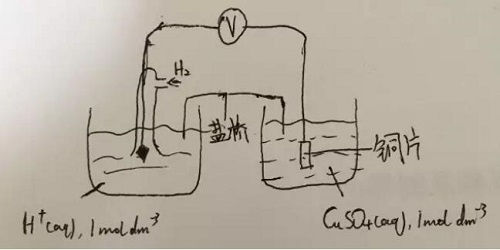
此图要点:
1.这张图是连接两个半电池的通用方法,需要牢记
2.需记住溶液都是1mol/L的
3.盐桥(salt bridge)通常由硝酸钾做成,也可以是别的材料。作用是使得两个半电池中的离子可以通过,注意,是离子,电子无法通过。
通过这张图,我们知道连接两个半电池的方法,需要注意的是半电池可以是金属/金属离子,非金属/非金属离子,离子/离子。下面讲各种半电池的画法:
金属/金属离子:参照上图Cu2+/Cu半电池
非金属/金属离子:氢半电池就是个例子,还可以是Cl-/Cl。图和氢半电池一样
离子/离子:比如,Fe3+/Fe2+ ,见图:
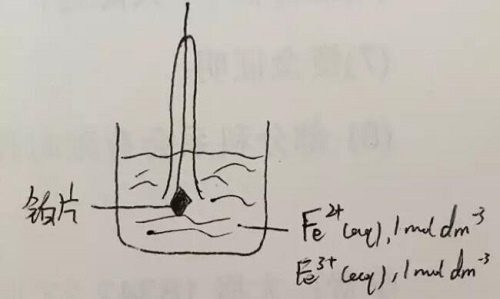
现在再来看如何计算原电池的电压
我们看到这样一个原电池:
1.判断两个半电池方程式
2.查data booklet,找到对应的电极电势
3.通过电极电势,判断正负极,上面讲过,电极电势越正,阳离子越容易得电子,所以金属还原性越弱,更容易接受电子,而接受电子的为正极。相反,电极电势越负,金属的还原性越强,更容易失去电子,而失去电子的为负极。
4.判断完正负极,就可以用计算原电池的电势了,直接用正极电极电势减去负极的就好。
通过电极电势,我们还可以判断一个原电池中的电子流向,方法就是判断完正负极,再通过电子是从负极流向正极来判断。这是个考点哟。
整理一下判断的技巧:
正极发生还原反应,负极发生氧化反应(和电解池相反)
电极电势越正,阳离子更容易得电子,既氧化性越强,对应元素单质的还原性就越弱,反之亦然
电极电势越正的半电池做正极,越负的做负极

- 上一篇:英国大学对IB学生是否友好?
- 下一篇:娄思宇:申请季,会做“选择”的人才能走得更远




