A-level化学知识点梳理系列(三)
点击量: 发布日期:2019-06-22 作者:四老师
原子中的电子排布(一)
在之前的章节中,我们已经了解了原子的基本结构,知道各种原子之所以不同,并且在元素周期表上占据不同的位置,是因为原子核中的质子数不同。中性原子的电子数与质子数相同,那么,围绕着原子核运动的电子又是如何排布的呢,与元素的化学性质又有什么密切的关系呢?这就是本章将要解决的内容。
一、原子的简单结构及其实验证据
围绕着原子核的许多电子,并不是杂乱无章地运动。我们可以把原子想象成一个极其微小的太阳系,电子在各自的轨道上运动,正如行星在各自的轨道上围绕着太阳转动。电子的排布结构称为电子的构型(electronic configuration)。我们首先要知道的是,电子是分层的,称为能级(energy level)或者主量子层(principal quantum shell),不同能级的能量从原子核向外依次增加,而电子优先排布在能量低的能级上。对于第n能级来说,能够容纳的电子数为2n2,这也就是为什么第一周期只有2种元素,第二周期有8种元素。
原子如此微小,更何况电子还在飞速运动,科学家又是如何知道电子是分层的呢,原来是有实验证据的支撑。首先,我们要引入一个概念叫做电离能(ionization energy),第一电离能是指从1mol气态原子中,每个原子各移除一个电子,形成+1价阳离子所需的能量。大家可以想想第二或者第三电离能是什么意思。我们来看一道真题,就是考察对这个概念的理解。
真题解析:s12

言归正传,为什么电离能可以成为电子分层的实验证据呢?对于一个原子来说,它的电离能是依次递增的,这一点不难理解,但是,递增的速度并不是均一的,而是某些电离能的数值发生跳跃,每当发生这种飞跃时,说明电离能突然增大的这个电子是从能量较低的新的能级移除的。实验数据可以是以图片或者表格的形式展示给我们,需要我们自行判断“飞跃”所在的位置。我们看下面的例子。
真题解析:w07

二、亚层与原子轨道
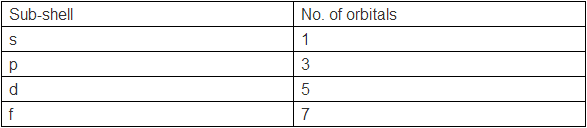
我们刚才已经了解到,电子是处在不同的能级上的,那么,同一能级上的电子还有区别吗?答案是肯定的。同一能级还可以进一步区分为亚层,共有s,p,d,f四种,并且能量依次升高。下表总结了能级与亚层的关系:

9年专注国际课程辅导培训
alevel、IB、AP、SAT2、IGCSE
上海天山总部:长宁区SOHO天山广场
上海浦东校区:浦东新区商城路618号良友大厦
上海七宝校区:闵行区新龙路399弄1号宝龙城
咨询热线:4006-321-553
广州校区:天河区体育西维多利广场
咨询热线:4006-321-556
宁波校区:宁波市鄞州区钱湖北路555号知识星球
咨询热线:4006-321-572




