名师专栏
A-level化学知识点梳理系列(一)
点击量: 发布日期:2017-02-07 16:15 作者:四老师
原子结构与摩尔的概念
A-level化学的AS阶段主要涵盖了三大块的内容,分别是化学理论、元素化学和有机化学。与物理和数学不同,要学好化学,不仅需要深刻地理解化学理论,还需要熟练记忆各种化合物的性质(颜色、气味,特殊的反应条件等),所以光靠聪明是不行的,还需要下苦功夫。但是化学是一门非常有趣的科学,可以帮助我们了解自然的诸多奥秘,也与生活息息相关。就拿我们住的房子来说,化学可以告诉我们钢筋水泥是怎么制造出来的,玻璃又是怎么制造出来的,煮饭的天然气从哪里来,冰箱和空调为什么可以制冷,又与热门的“南极臭氧层空洞”有什么联系……本系列讲义讲详细梳理各个章节的重要知识点,帮助同学们形成一个清晰的知识体系,同时配以真题讲解,迅速提高解题能力,向高分冲刺。本期将对原子结构与摩尔的概念(CIE版第一、二章)进行专题讲解。这一期将会引入很多化学的基本概念,让大家逐步适应化学的思维方式。
一、原子的基本结构
大家需要知道原子的基本结构(如下图所示),知道各种亚原子微粒的名称和基本性质(如下表所示)。
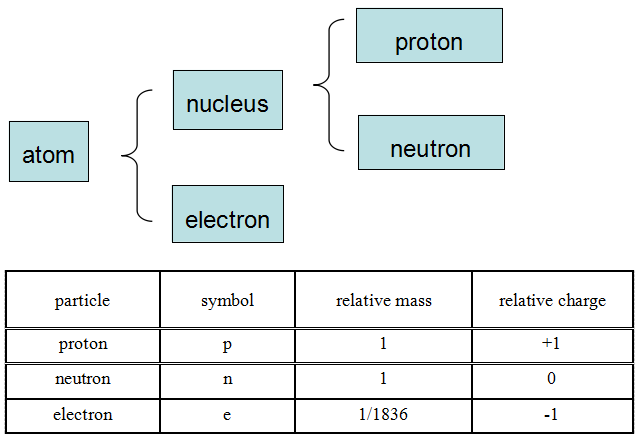
记住了各种微粒的性质,我们就能解释粒子在电场中的偏转行为(偏向正极或负极,偏转角度的大小)。
下面两个公式非常重要:
原子序数=质子数=电子数
质量数=核子数=质子数+中子数
同时我们还需要理解同位素的概念。这里的“位”是指在元素周期表中的位置,同位素就是质子数相同而中子数不同的同类原子。
真题解析:W10

这道题看似简单,但是计算量很大,需要考生沉稳,不能急躁。A中质子数为5,中子数为6,电子数为5。B中质子数为9,中子数为10,电子数为10。C中质子数为11,中子数为12,电子数为10。D中质子数和中子数均为12,电子数为10。因此选择C。
二、原子与分子的质量,摩尔的概念
在日常生活中,我们使用的质量单位是克和千克。原子虽然非常微小,但是也有质量。可是如果使用克和千克作为单位,单位前的数字一定非常小,使用起来很不方便,因此有必要创造一种新的单位,这就是相对原子质量的由来。我们把C-12(碳元素的一种同位素)原子的质量的1/12定义为相对原子质量的一个单位,所以严格地讲,相对原子质量是一个比值。
相对分子质量就是把这个分子包含的所有原子的相对原子质量相加。有些物质是用化学式表示的,而不存在分子式(如离子化合物),因此相对化学式质量就是把化学式中各个原子的相对原子质量相加。
自然界中同一种元素的不同的同位素有一个比例分布,可以用质谱仪测量,我们可以据此计算出元素的平均相对原子质量。
下面我们重点介绍物质的量的概念。这可能是本讲中最难的概念,但同时又是最关键的概念。物质的量的单位是摩尔(mole),初次接触这个概念的同学基本上都是困惑的,这到底是怎样的一个单位?我个人的理解是,摩尔是沟通微观世界和宏观世界的桥梁。在微观世界,我们会问,这里面有多少个粒子;而在宏观世界,我们会问,这堆物质有多少质量(单位是克)。如果没有摩尔的概念,我们实在难以回答这样的问题:多少个水分子会是1克?然而有了摩尔的概念,这个问题就变得很轻松了,我们只需要记住两个公式:
粒子数=摩尔数*阿伏伽德罗常数
质量=摩尔数*相对原子(分子)质量
其中,阿伏伽德罗常数是一个天文数字(6.02E23),之所以选择这么奇怪的一个数字,正是为了1mol物质的质量以克为单位时,数值能够与相对原子(分子)质量相同,大家要用心体会阿伏伽德罗老前辈的良苦用心。
真题解析:S 12

下一讲讲围绕着关于摩尔概念的计算展开,不仅会将选择题,还会讲到分值很高的计算题,请同学们持续关注。



