名师专栏
A-level化学知识点梳理系列(四)
点击量: 发布日期:2017-02-07 16:03 作者:四老师
原子中的电子排布(二)
原子中电子的排布是一个非常有意思的问题。在上一章的讲义中,我们已经掌握了能级、亚层和轨道的概念,在本章的讲义中,我们将系统地介绍电子的排布规律。一、电子构型
原子中电子的排布顺序是由能量低的亚层到能量高的亚层。一般来说,能级越低,能量越低,在同一能级中,s亚层低于p亚层,低于d亚层,低于f亚层。然而电子的实际排布比以上的规律复杂,会出现能级交错现象,填充的顺序是:1s<2s<2p<3s<3p<4s<3d<4p,这里重点要记住的是4s<3d。另一方面,当一个亚层出现全充满或者半充满情况时,原子的结构会特别稳定,因此会出现如下反常的情况:
24Cr: [Ar]3d54s1
29Cu: [Ar]3d104s1
同时,当原子丢失电子形成离子时,优先失去最外能级的电子:
Ti2+: [Ar]3d2
Cr3+: [Ar]3d3
原子的电子排布与在元素周期表的位置有着紧密的联系,s区、p区和d区元素的原子,能量最高的电子分别处于s亚层、p亚层和d亚层。
当电子依次占领某个亚层时,首先会以自旋相同的方向优先占领尽可能多的空轨道,达到半充满结构,然后再以自旋相反的方向填满所有轨道。记住一个轨道最多可以填充一对自旋方向相反的电子。
我们来看道真题。
s12-question paper 11

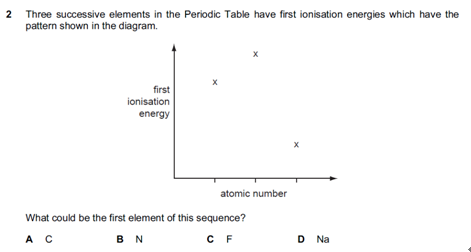
二、元素周期表中电离能的变化规律
影响电离能(ionization energy)的因素有三个:
1. 核电荷数:核电荷数越大,电离能越大;
2. 外层电子到原子核的距离:外层电子越远,电离能越低;
3. 屏蔽效应:与内部的完整电子层层数相关,完整电子层越多,屏蔽效应越大,电离能越小。
下面我们依次介绍以下五种情况下的电离能趋势:
1. 同周期
核电荷数增大,原子核与外层电子的距离大致不变,屏蔽效应大致不变,因此电离能呈现增大趋势(不是严格递增)。
2. 上一周期的最后一个元素到下一周期的第一个元素
原子核与最外层电子距离增加,屏蔽效应增加,这两个因素超过了核电荷数的增加,因此电离能迅速降低。
3. Be到B
原子核与外层电子的距离有一定程度的增加,屏蔽效应有一定程度的增加,这两个因素超过了核电荷数的增加,因此电离能有轻微的下降。
4. N到O
N原子中2p轨道处于半充满状态,而O原子的2p亚层中,电子比半充满状态多了一个电子,因此由于自旋电子对的排斥,电离能有轻微下降。
5. 同一主族
自上而下,原子核与外层电子的距离增加,屏蔽效应增加,这两个因素超过了核电荷数的增加,因此电离能下降。
我们来看一道真题: w 06