名师专栏
A-level化学知识点梳理系列(五)
点击量: 发布日期:2017-02-07 15:59 作者:四老师
责任编辑:Hellen
化学键与物质状态(一)
在前面的课程中,我们学习到了很多关于原子的知识,包括原子核和核外的电子排布。那么,原子又是如何组成我们形形色色的大千世界的呢?首先,我们要了解原子和原子之间的相互作用,也就是所谓的化学键,这是原子构成宏观物质的第一步。化学键主要有三种,即离子键、共价键和金属键,这些统称为强相互作用。还有一类弱相互作用,存在于分子之间,包括范德华力、永久偶极矩和氢键。下面我们将依次介绍。
一、离子键
绝大多数离子键都存在于金属原子和非金属原子之间,通过电子的转移,金属原子成为阳离子,非金属原子成为阴离子,而离子键的本质就是阴阳离子之间的静电吸引。值得注意的是,BeCl2和AlCl3虽然是由金属原子和非金属原子组成的,却是共价化合物,这个特例需要牢记。同时,应掌握离子化合物的点叉图画法。
二、共价键
当两个非金属原子结合在一起,共享电子对,成为共价键。如果共用一对电子对,就称为单键,共用两对称为双键,共用三对称为三键。Cl2分子中,两个Cl原子之间就是单键;O2分子中,两个O原子之间就是双键;N2分子中,两个N原子之间就是三键。可能有人会问,为什么有的是单键,有的是双键,有的是三键呢?原因在于,所有的原子都有一种趋势,就是获得与之最邻近的稀有气体元素的电子层结构。Cl原子最外层本身就有7个电子,因此只需要与另一个Cl原子共用一对电子,就能获得8电子的稳定结构。以此类推。
共价化合物的点叉图画法也是应该掌握的,值得注意的是BF3和SF6中的中心原子最外层并不是8个电子,作为特例也应该记住。
配位键是一种特殊的共价键,由一个原子提供电子对,另一个原子提供空轨道,最典型的例子是NH4+和AlCl3二聚体。
键能的定义是:打断1mol气态分子中的共价键所需要的能量。键能越大,键长越短。
关于共价键的知识点比较多,我们看两道真题来消化一下。
s12-qp11

这道题中的A、B、C选项本身都是正确的,AlCl3在气态是以二聚体的形式存在的,AlCl3是一个共价分子。AlCl3中Al原子周围有6个电子,有一个空轨道,所以可以和Cl-形成配位键。所以这道题目应该选择C。
s12-qp11

这道题考察的是共价键共用电子的概念。A选项中的B原子本来最外层有3个电子,分享来自F原子的3个电子,所以最外层共有6个电子。B选项中的C原子,本来最外层有4个电子,分享到来自H原子的3个电子,并且作为阴离子,还得到1个电子,所以一共有8个外层电子。C选项中的O原子本来有6个电子,得到来自F原子的2个电子,所以一共有8个外层电子。D选项中的O原子本来有6个电子,得到来自2个H原子的2个电子,而H+没有电子,所以最终也是8个电子。选A。
三、分子的形状
为了解释分子的形状,先要理解电子对排斥理论,包括以下三个要点:
1、围绕同一中心原子的电子对会互相排斥,尽可能远离;
2、决定键角的因素是电子对的数目,以及这些电子对是孤对电子对还是成键电子对;
3、排斥作用从大到小的顺序是孤对-孤对、孤对-成键、成键-成键。
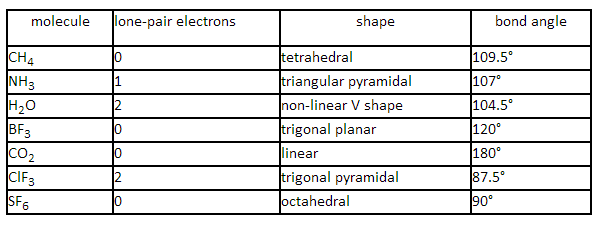
最后还要理解σ 键和 π 键的概念,CH3-CH3 分子中H-C-H 的键角是 109.5°,CH2=CH2 分子中H-C-H 的键角是117°
我们来看道真题深化理解。
s12-qp12
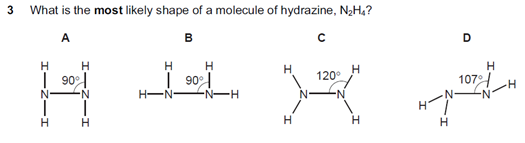
N原子周围有4对电子对,所以键角应该接近109.5°,其中3对是成键电子对,1对是孤对电子对,由于孤对-成键的排斥作用大于成键-成键,因此键角为107°,选D选项。
化学键与物质状态(一)
在前面的课程中,我们学习到了很多关于原子的知识,包括原子核和核外的电子排布。那么,原子又是如何组成我们形形色色的大千世界的呢?首先,我们要了解原子和原子之间的相互作用,也就是所谓的化学键,这是原子构成宏观物质的第一步。化学键主要有三种,即离子键、共价键和金属键,这些统称为强相互作用。还有一类弱相互作用,存在于分子之间,包括范德华力、永久偶极矩和氢键。下面我们将依次介绍。
一、离子键
绝大多数离子键都存在于金属原子和非金属原子之间,通过电子的转移,金属原子成为阳离子,非金属原子成为阴离子,而离子键的本质就是阴阳离子之间的静电吸引。值得注意的是,BeCl2和AlCl3虽然是由金属原子和非金属原子组成的,却是共价化合物,这个特例需要牢记。同时,应掌握离子化合物的点叉图画法。
二、共价键
当两个非金属原子结合在一起,共享电子对,成为共价键。如果共用一对电子对,就称为单键,共用两对称为双键,共用三对称为三键。Cl2分子中,两个Cl原子之间就是单键;O2分子中,两个O原子之间就是双键;N2分子中,两个N原子之间就是三键。可能有人会问,为什么有的是单键,有的是双键,有的是三键呢?原因在于,所有的原子都有一种趋势,就是获得与之最邻近的稀有气体元素的电子层结构。Cl原子最外层本身就有7个电子,因此只需要与另一个Cl原子共用一对电子,就能获得8电子的稳定结构。以此类推。
共价化合物的点叉图画法也是应该掌握的,值得注意的是BF3和SF6中的中心原子最外层并不是8个电子,作为特例也应该记住。
配位键是一种特殊的共价键,由一个原子提供电子对,另一个原子提供空轨道,最典型的例子是NH4+和AlCl3二聚体。
键能的定义是:打断1mol气态分子中的共价键所需要的能量。键能越大,键长越短。
关于共价键的知识点比较多,我们看两道真题来消化一下。
s12-qp11

这道题中的A、B、C选项本身都是正确的,AlCl3在气态是以二聚体的形式存在的,AlCl3是一个共价分子。AlCl3中Al原子周围有6个电子,有一个空轨道,所以可以和Cl-形成配位键。所以这道题目应该选择C。
s12-qp11

这道题考察的是共价键共用电子的概念。A选项中的B原子本来最外层有3个电子,分享来自F原子的3个电子,所以最外层共有6个电子。B选项中的C原子,本来最外层有4个电子,分享到来自H原子的3个电子,并且作为阴离子,还得到1个电子,所以一共有8个外层电子。C选项中的O原子本来有6个电子,得到来自F原子的2个电子,所以一共有8个外层电子。D选项中的O原子本来有6个电子,得到来自2个H原子的2个电子,而H+没有电子,所以最终也是8个电子。选A。
三、分子的形状
为了解释分子的形状,先要理解电子对排斥理论,包括以下三个要点:
1、围绕同一中心原子的电子对会互相排斥,尽可能远离;
2、决定键角的因素是电子对的数目,以及这些电子对是孤对电子对还是成键电子对;
3、排斥作用从大到小的顺序是孤对-孤对、孤对-成键、成键-成键。

最后还要理解σ 键和 π 键的概念,CH3-CH3 分子中H-C-H 的键角是 109.5°,CH2=CH2 分子中H-C-H 的键角是117°
我们来看道真题深化理解。
s12-qp12

N原子周围有4对电子对,所以键角应该接近109.5°,其中3对是成键电子对,1对是孤对电子对,由于孤对-成键的排斥作用大于成键-成键,因此键角为107°,选D选项。




